
zm
106, Nr. 24 A, 16.12.2016, (1510)
B
Die Meldungen zu Vorkommnissen mit
Medizinprodukten tragen seit vielen Jahren
dazu bei, die Sicherheit beziehungsweise
Qualität von Medizinprodukten kontinuier-
lich zu überwachen. Deshalb sind nach
§ 3 Medizinprodukte-Sicherheitsplanver-
ordnung (MPSV) alle Anwender und Betrei-
ber von Medizinprodukten verpflichtet,
Vorkommnisse mit Medizinprodukten dem
Bundesinstitut für Arzneimittel und Medi-
zinprodukte (BfArM) zu melden. Die Ver-
pflichtung galt bisher für Zahnärzte erfüllt,
wenn die Meldung an die Arzneimittelkom-
mission Zahnärzte (AKZ) erfolgte.
Mit dem Inkrafttreten einer Gesetzesände-
rung am 1. Januar 2017 entfällt dieser Mel-
deweg. Ab diesem Zeitpunkt sind alle Ange-
hörigen der Heilberufe verpflichtet, Vor-
kommnisse direkt elektronisch an das BfArM
zu melden. Vor diesem Hintergrund ist für
ein rechtssicheres Verhalten die Betrachtung
der gesetzlichen Begriffsdefinition von be-
sonderer Bedeutung.
Meldung direkt
an das Bundesinstitut
Nach MPSV bezeichnet ein Vorkommnis
„eine Funktionsstörung, einen Ausfall, eine
Änderung der Merkmale oder der Leistung
oder eine unsachgemäße Kennzeichnung
der Gebrauchsanweisung eines Medizinpro-
dukts, die unmittelbar oder mittelbar zum
Tod oder zu einer schwerwiegenden Ver-
schlechterung des Gesundheitszustands
eines Patienten, eines Anwenders oder einer
anderen Person geführt hat, geführt haben
könnte oder führen könnte; als Funktions-
störung gilt auch ein Mangel der Ge-
brauchstauglichkeit, der eine Fehlanwen-
dung verursacht.“ Weiterhin ist eine
schwerwiegende Verschlechterung des
Gesundheitszustandes als „eine lebensbe-
drohliche Erkrankung oder Verschlechte-
rung, eine stationäre Behandlung oder die
Verlängerung einer stationären Behandlung
oder eine medizinische oder chirurgische
Intervention zur Verhinderung einer lebens-
bedrohlichen Erkrankung oder Verletzung
oder eines bleibenden Körperschadens oder
einer dauerhaften Beeinträchtigung einer
Körperfunktion“ definiert. Aus den sprach-
lich sperrigen Formulierungen wird deut-
lich, dass nicht Bagatellen, sondern nur
besonders folgenschwere Vorkommnisse
beziehungsweise deren mögliches Eintreten
der Meldepflicht unterliegen. Für das Gebiet
der Zahnheilkunde könnte dies zum Beispiel
die Fraktur einer Injektionskanüle sein, die
eine stationäre, chirurgische Intervention
nach sich zieht oder ziehen könnte. Es liegt
auf der Hand, dass solche Zwischenfälle
(glücklicherweise) in Zahnarztpraxen sehr
selten eintreten. Auf jeden Fall sollte aber
jeder Kollege über die Meldepflicht und den
Meldeweg informiert sein und für ein unver-
zügliches Handeln der Link zur elektroni-
schen Meldung in jeder Praxis, zum Beispiel
im QM-System, hinterlegt werden. Das
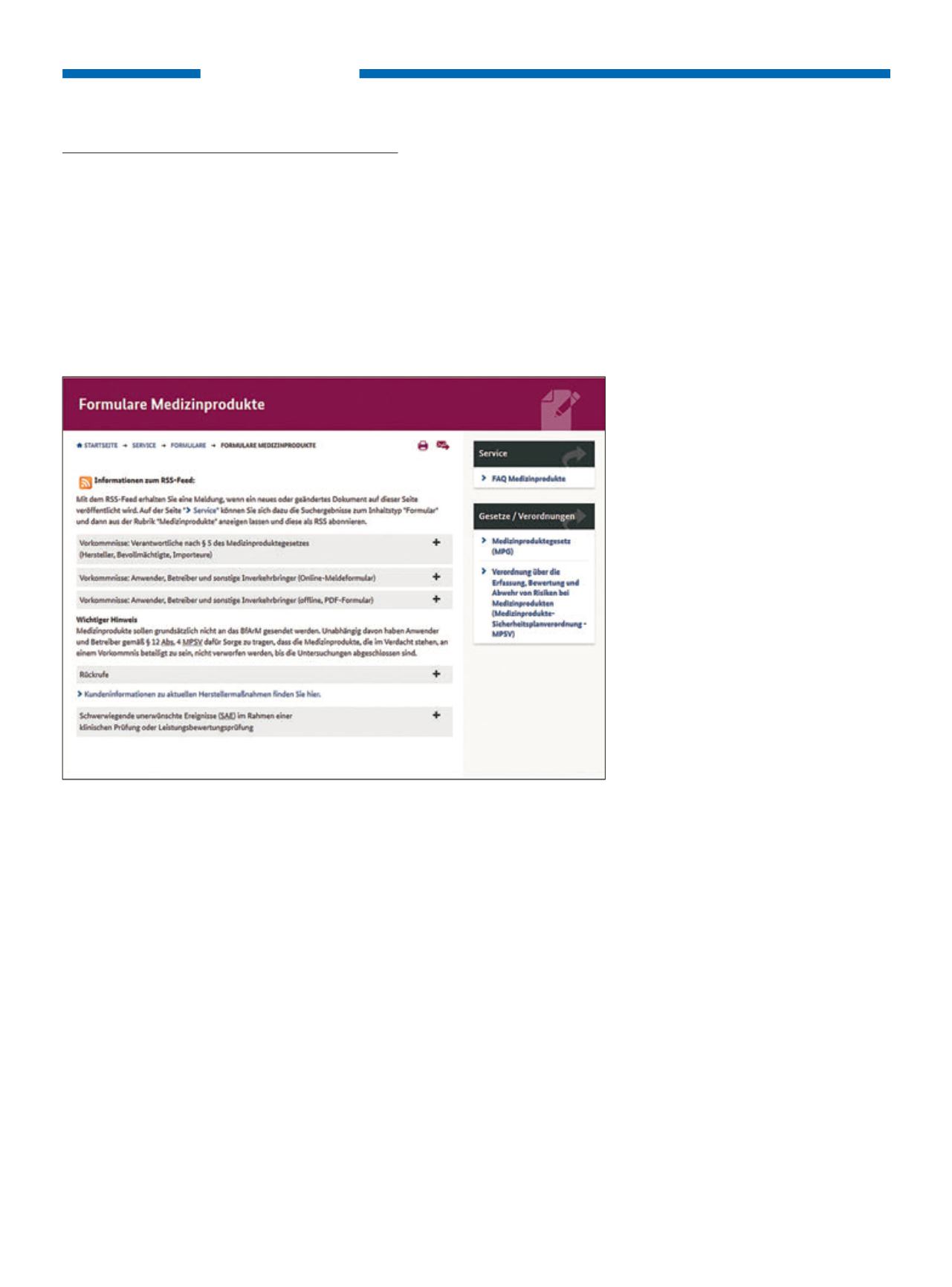
Formblatt für die Meldung von Vorkomm-
nissen durch Anwender, Betreiber und sons-
tige Inverkehrbringer nach § 3 Absatz 2 bis 4
der Medizinprodukte-Sicherheitsplanver-
ordnung finden Sie unter: http://www.
bfarm.de/DE/Service/Formulare/functions/Medizinprodukte/_node.html
Bitte übermitteln Sie die Daten durch
Die Arzneimittelkommission Zahnärzte informiert
Medizinprodukterecht:
Neues Meldeverfahren ab 2017
Zum 1. Januar 2017 tritt die Änderung des Meldeverfahrens zu Vorkommnissen
mit Medizinprodukten in Kraft. Ab diesem Zeitpunkt sind alle Angehörigen der
Heilberufe verpflichtet, Vorkommnisse direkt elektronisch an das Bundesinstitut
für Arzneimittel und Medizinprodukte zu melden.
Auf der Website des Bundesinstituts für Arzneimittel und Medizinprodukte
(www.bfarm.de)
stehen die Meldeformulare zum Download zur Verfügung.
Foto: Bundesinstitut für Arzneimittel und Medizinprodukte
44
Zahnmedizin


















